カスタム部品製造ソリューション
医療機器部品製造サービス
Newayは医療機器部品の製造に特化しており、CNC加工、3Dプリンティング、真空鋳造、ダイキャストおよび射出成形サービスを提供しています。私たちは、高精度で生体適合性のある部品を保証し、業界の厳しい基準に準拠した医療機器業界向けに信頼性の高い耐久性のあるソリューションを提供します。
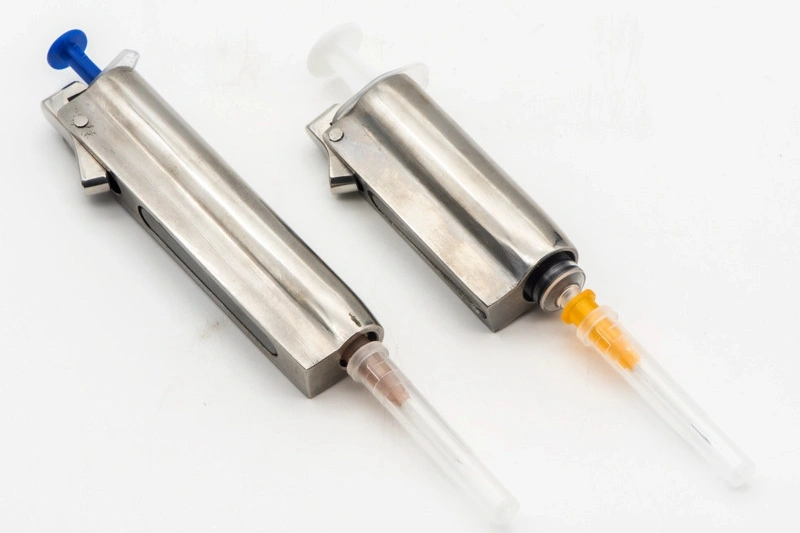
医療機器部品加工
医療機器部品加工は、ミリング、ターンニング、ドリル、グラインディングなど、高精度なCNC加工プロセスを含みます。これらは高品質な医療用途部品を生産するために使用され、マルチアクスおよび精密加工技術、またはEDM(放電加工)を利用して、厳密な公差と信頼性を保証します。これらの方法は、医療業界の厳しい安全基準と性能基準に合致する部品の製造に欠かせません。
医療機器用材料選定
スーパーロイ、チタン、アルミニウム、銅、真鍮、青銅、炭素鋼、ステンレス鋼、プラスチック、セラミックなどの材料は、医療機器の製造に不可欠です。これらの材料は、インプラント、外科用ツール、プロステーシス、医療機器のコンポーネントに耐久性、生体適合性、精度を提供します。
医療機器部品における代表的な表面処理
医療機器部品における代表的な表面処理には、アルマイト処理、電解研磨、PVD、粉体塗装、パッシベーションおよび熱処理などがあります。これらの処理は、生体適合性、耐腐食性、耐久性を高めます。電解研磨やアルマイト処理は表面の滑らかさを向上させ、テフロンコーティングやUVコーティングは追加の保護を提供し、医療機器が厳格な性能と安全基準を満たすことを保証します。
医療機器CNC加工ソリューション
CNC加工は医療機器において非常に重要で、外科用ツール、インプラント、診断機器などの精密部品を製造し、精度、生体適合性、安全性の厳格な基準を満たします。
本日新しいプロジェクトを開始しましょう
医療機器部品の設計ガイドライン
医療機器部品の設計には精度、清潔さ、規制の遵守、ユーザー安全性が必要です。この記事では、臨床使用時に信頼性があり、清掃が容易で、認証要件を満たす部品を保証するためのエンジニアリング原則を概説します。





































