Soluciones de Fabricación de Piezas Personalizadas
Servicios de Fabricación de Piezas para Dispositivos Médicos
Neway se especializa en la fabricación de piezas para dispositivos médicos, ofreciendo procesamiento CNC, impresión 3D, fundición al vacío, fundición a presión y moldeo por inyección. Aseguramos entregar componentes de alta precisión y biocompatibles que cumplen con los estrictos estándares de la industria, ofreciendo soluciones confiables y duraderas para la industria de dispositivos médicos.
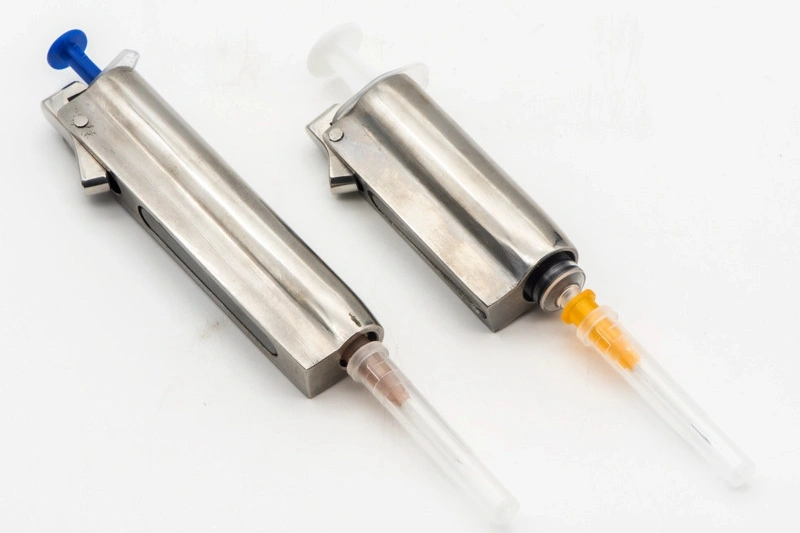
Procesamiento de Piezas para Dispositivos Médicos
El procesamiento de piezas para dispositivos médicos implica procesos precisos de CNC, como fresado, torneado, perforado y rectificado, para la producción de componentes médicos de alta calidad. Con técnicas de procesamiento de múltiples ejes y procesamiento de precisión, así como mecanizado por descarga eléctrica (EDM), se garantizan tolerancias estrictas y fiabilidad. Estos métodos son fundamentales para fabricar piezas que cumplan con los estrictos estándares de seguridad y rendimiento de la industria médica.
Selección de Materiales para Dispositivos Médicos
Materiales como superaleaciones, titanio, aluminio, cobre, latón, bronce, acero al carbono, acero inoxidable, plásticos y cerámicas son fundamentales en la fabricación de dispositivos médicos. Estos materiales proporcionan durabilidad, biocompatibilidad y precisión para componentes de implantes, instrumentos quirúrgicos y dispositivos médicos.
Tratamientos Típicos de Superficie para Piezas de Dispositivos Médicos
Los tratamientos de superficie típicos para piezas de dispositivos médicos incluyen anodizado, pulido eléctrico, PVD, recubrimiento en polvo, pasivación y tratamiento térmico. Estos tratamientos mejoran la biocompatibilidad, la resistencia a la corrosión y la durabilidad. Procesos como el pulido eléctrico y anodizado mejoran la suavidad de la superficie, mientras que recubrimientos como Teflon o recubrimientos UV brindan protección adicional para garantizar que los dispositivos médicos cumplan con estrictos estándares de rendimiento y seguridad.

Más información
Recubrimiento Térmico

Más información
Acabado Tal Cual Procesado

Más información
Pintura

Más información
PVD (Deposición Física de Vapor)

Más información
Granallado

Más información
Electrochapado

Más información
Pulido

Más información
Anodizado

Más información
Recubrimiento en Polvo

Más información
Electropulido

Más información
Pasivación

Más información
Cepillado

Más información
Óxido Negro

Más información
Tratamiento Térmico

Más información
Recubrimiento de Barrera Térmica (TBC)

Más información
Pulido en Tambor

Más información
Alodine

Más información
Recubrimiento de Cromo

Más información
Fosfatado

Más información
Nitruración

Más información
Galvanizado

Más información
Recubrimiento UV

Más información
Recubrimiento de Laca

Más información
Recubrimiento de Teflón
Soluciones de Procesamiento CNC para Dispositivos Médicos
El procesamiento CNC es esencial en dispositivos médicos para fabricar piezas precisas como instrumentos quirúrgicos, implantes y equipos de diagnóstico, cumpliendo con estrictos estándares de precisión, biocompatibilidad y seguridad.
Comencemos un nuevo proyecto hoy
Guía de Diseño de Piezas para Dispositivos Médicos
Las piezas para dispositivos médicos requieren precisión, limpieza, cumplimiento de normativas y seguridad para el usuario. Este artículo describe los principios de ingeniería para asegurar que las piezas sean funcionales, fáciles de limpiar y cumplan con los requisitos de certificación.













