Soluções para Fabricação de Peças Sob Encomenda
Serviços de Fabricação de Peças para Dispositivos Médicos
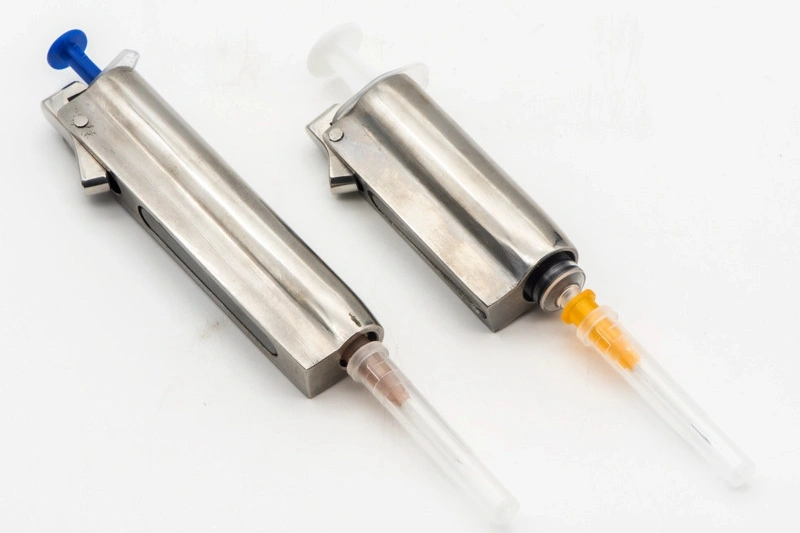
A Neway se especializa na fabricação de peças para dispositivos médicos, oferecendo processamento CNC, impressão 3D, fundição a vácuo, fundição sob pressão e moldagem por injeção. Garantimos componentes biocompatíveis e de alta precisão, que atendem aos rigorosos padrões da indústria, fornecendo soluções confiáveis e duráveis para o setor médico.
Processamento de Peças para Dispositivos Médicos
O processamento de peças para dispositivos médicos envolve processos CNC de alta precisão, como fresamento, torneamento, furação e retificação, usados para fabricar componentes de alta qualidade para aplicações médicas. Utilizando tecnologias de múltiplos eixos e processamento de precisão, bem como usinagem por descarga elétrica (EDM), garantimos tolerâncias apertadas e confiabilidade. Esses métodos são essenciais para fabricar peças que atendem aos rigorosos padrões de segurança e desempenho da indústria médica.
Seleção de Materiais para Dispositivos Médicos
Materiais como superligas, titânio, alumínio, cobre, latão, bronze, aço carbono, aço inoxidável, plásticos e cerâmicas são essenciais para a fabricação de dispositivos médicos. Esses materiais fornecem durabilidade, biocompatibilidade e precisão para componentes de implantes, instrumentos cirúrgicos, próteses e equipamentos médicos.
Acabamentos Superficiais Típicos para Peças de Dispositivos Médicos
Os acabamentos superficiais típicos para peças de dispositivos médicos incluem anodização, polimento eletroquímico, PVD, revestimento a pó, passivação e tratamento térmico. Esses tratamentos podem melhorar a biocompatibilidade, resistência à corrosão e durabilidade. Processos como polimento eletroquímico e anodização melhoram a suavidade da superfície, enquanto revestimentos de teflon ou UV oferecem proteção adicional, garantindo que os dispositivos médicos atendam aos rigorosos padrões de desempenho e segurança.

Saber Mais
Revestimento Térmico

Saber Mais
Superfície Pós-Processamento

Saber Mais
Pintura

Saber Mais
PVD (Deposição Física de Vapor)

Saber Mais
Jateamento de Areia

Saber Mais
Eletrodeposição

Saber Mais
Polimento

Saber Mais
Anodização

Saber Mais
Revestimento em Pó

Saber Mais
Polimento Eletrolítico

Saber Mais
Passivação

Saber Mais
Escovamento

Saber Mais
Óxido Negro

Saber Mais
Tratamento Térmico

Saber Mais
Revestimento Térmico (TBC)

Saber Mais
Tambor

Saber Mais
Alodine

Saber Mais
Revestimento de Cromo

Saber Mais
Fosfatização

Saber Mais
Nitretação

Saber Mais
Galvanização

Saber Mais
Revestimento UV

Saber Mais
Revestimento de Verniz

Saber Mais
Revestimento de Teflon
Soluções de Processamento CNC para Dispositivos Médicos
O processamento CNC é fundamental para a fabricação de dispositivos médicos, como instrumentos cirúrgicos, implantes e equipamentos de diagnóstico, que atendem aos rigorosos padrões de precisão, biocompatibilidade e segurança.
Comece um novo projeto hoje
Diretrizes de Design de Peças para Dispositivos Médicos
O design de peças para dispositivos médicos requer precisão, limpeza, conformidade com regulamentações e segurança do usuário. Este artigo descreve os princípios de engenharia para garantir que os componentes funcionem de forma confiável, sejam fáceis de limpar e atendam aos requisitos de certificação.













