Solutions de Fabrication de Pièces Personnalisées
Services de Fabrication de Pièces pour Dispositifs Médicaux
Neway se spécialise dans la fabrication de pièces pour dispositifs médicaux, offrant des services de traitement CNC, impression 3D, moulage sous vide, moulage sous pression et moulage par injection. Nous assurons des composants de haute précision, biocompatibles et conformes aux normes strictes de l'industrie, fournissant des solutions fiables et durables pour le secteur des dispositifs médicaux.
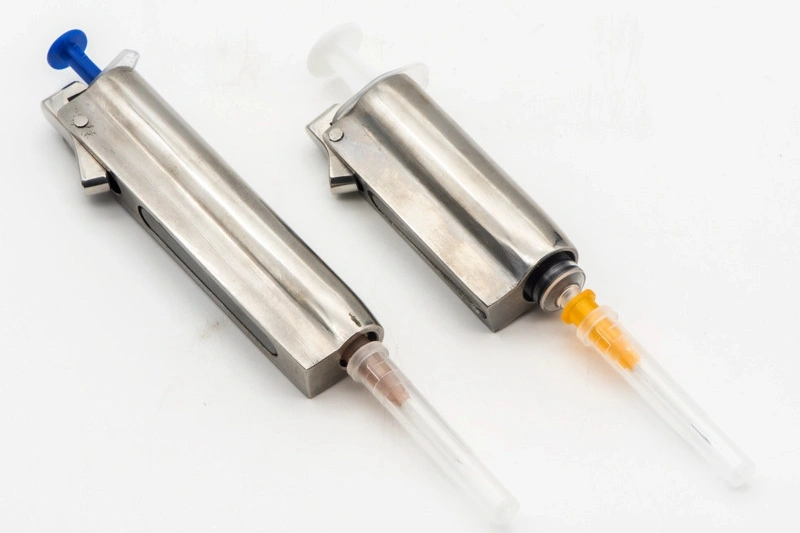
Usinage des Pièces pour Dispositifs Médicaux
L'usinage des pièces pour dispositifs médicaux comprend des processus CNC précis, tels que le fraisage, le tournage, le perçage et le rectification, utilisés pour produire des composants médicaux de haute qualité. Des techniques de traitement multi-axes et de précision, ainsi que l'usinage par décharge électrique (EDM), assurent des tolérances serrées et une fiabilité. Ces méthodes sont essentielles pour la fabrication de pièces conformes aux normes strictes de sécurité et de performance de l'industrie médicale.
Sélection des Matériaux pour Dispositifs Médicaux
Les matériaux tels que les superalliages, le titane, l'aluminium, le cuivre, le laiton, le bronze, l'acier au carbone, l'acier inoxydable, les plastiques et les céramiques sont essentiels dans la fabrication des dispositifs médicaux. Ces matériaux offrent durabilité, biocompatibilité et précision pour des composants d'implants, instruments chirurgicaux et dispositifs médicaux.
Traitements de Surface Typiques pour Pièces Médicales
Les traitements de surface typiques pour les pièces de dispositifs médicaux incluent l'anodisation, le polissage électrolytique, le PVD, le revêtement en poudre, la passivation et le traitement thermique. Ces traitements améliorent la biocompatibilité, la résistance à la corrosion et la durabilité. Des processus tels que le polissage électrolytique et l'anodisation améliorent la douceur de la surface, tandis que des revêtements comme le Teflon ou le revêtement UV offrent une protection supplémentaire, garantissant ainsi que les dispositifs médicaux respectent des normes strictes de performance et de sécurité.

En savoir plus
Revêtement Thermique

En savoir plus
Finition Brute

En savoir plus
Peinture

En savoir plus
PVD (Dépôt Physique en Phase Vapeur)

En savoir plus
Sablage

En savoir plus
Électroplaquage

En savoir plus
Polissage

En savoir plus
Anodisation

En savoir plus
Revêtement en Poudre

En savoir plus
Électropolissage

En savoir plus
Passivation

En savoir plus
Brossage

En savoir plus
Oxyde Noir

En savoir plus
Traitement Thermique

En savoir plus
Revêtement de Barrière Thermique (TBC)

En savoir plus
Polissage en Tambour

En savoir plus
Alodine

En savoir plus
Chromage

En savoir plus
Phosphatation

En savoir plus
Nitruration

En savoir plus
Galvanisation

En savoir plus
Revêtement UV

En savoir plus
Revêtement de Laque

En savoir plus
Revêtement Téflon
Solutions CNC pour Dispositifs Médicaux
L'usinage CNC est essentiel dans la fabrication de dispositifs médicaux pour produire des pièces précises comme des instruments chirurgicaux, des implants et des équipements de diagnostic, répondant aux normes strictes de précision, de biocompatibilité et de sécurité.
Commençons un nouveau projet aujourd'hui
Guide de Conception des Pièces pour Dispositifs Médicaux
Les pièces pour dispositifs médicaux nécessitent précision, propreté, conformité aux réglementations et sécurité pour l'utilisateur. Cet article décrit les principes d'ingénierie nécessaires pour garantir que les pièces fonctionnent de manière fiable, sont faciles à nettoyer et respectent les exigences de certification.













